Муниципальное общеобразовательное учреждение
«Стрелецкая средняя общеобразовательная школа
Белгородского района Белгородской области имени Героя Советского Союза А.Е.Черникова »
Технологическая карта урока по химии в 8 классе по теме:
« Основные классы неорганических соединений»
Автор: Крекшина Нина Александровна
Учитель химии и биологии
2013 год
Технологическая карта урока « Основные классы неорганических соединений»
8 класс
Дидактическая цель: обобщить и систематизировать материал по теме «Основные классы неорганических соединений», создать условия для самостоятельной работы школьников по указанной теме
Тип урока: обобщение и систематизация знаний и способов деятельности
Задачи урока:
1. Создать условия для конкретизации понятий «оксиды, кислоты, основания, соли », создать условия для закрепления таких понятий как классификация веществ, названия, свойства и их применение. (предметный результат).
2. Способствовать развитию интеллектуальных умений учащихся (сравнение, синтез, анализ, вывод), максимально включая их в процесс самореализации, формирование адекватной самооценки; искать аналогии и работать в команде, пользоваться альтернативными источниками информации (метапредметный результат).
3. Формирование умений управлять своей учебной деятельностью, формирование культуры монологической речи (химического языка) и представление результатов исследовательской работы по выявлению среды раствора с помощью индикатора…… (личностный результат).
Методы обучения: проблемный, эвристический, практический
Формы организации познавательной деятельности обучающихся: коллективная, индивидуальная, групповая.
Средства обучения: презентация, учебник, рабочие тетради, видеосюжет «демонстрация опыта», задания на карточках, лабораторное оборудование: (пробирки, штатив, реактивы), карточки рефлексии, ЭОР (сайты 
Сложные вещества
_
_________ __________ __________________ ________________
амфотерные _______________ _____________ ________________
______ ________ _________
кислые основные
____________________
_______________________________________________________________________________________________________________________
_
_________ __________ __________________ ________________
______________ _______________ _____________ ________________
______ ________ _________
-
«Найди родственников»
-
Вариант 1. Выписать в таблицу
все оксиды и кислоты и дать им названия :
Nа2SО3, Н2SО4, СrО3, НNO3, МgО, NaNО3, КОН
|
Кислоты |
Основания |
Соли |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Вариант 2. — Выписать в таблицу
все основания и соли и дать им названия
Мg(ОН)2, Н2SО4, ZnСl2, НNO3, МgО, NаNO3, КОН
|
Кислоты |
Основания |
Соли |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-
«Третий лишний»
Вариант 1. Найти лишнюю формулу, вычеркнуть её и назвать класс веществ:
1) Н20, К2SO4, SO2 — . . .;
2) ВаSО4, НСl, СuСl2 — . . . ;
3)NaОН, СuО, Сu(ОН)2 — . . . ;
4) Н2SО3, НСl, КNO3 — . . ..
4. «Третий лишний»
Вариант 2. Найти лишнюю формулу, вычеркнуть её и назвать класс веществ:
1) Н2SO3, LiNO3, Н2SO4 — . . .;
2) NаОН, Ва(ОН)2, Н2S — . . . ;
3) Nа2СO3, Р2O5, МgO — . . .;
4)АlРО4, СuSО4, Zn(ОН)2 — . . ..
-
Экспертиза. «Помоги Юному химику»
Цель: Распознать экспериментальным путем, в какой пробирке находится соль, кислота, щелочь
1) Продумайте результаты проведенных расследований.
2) Учащиеся делают анализ и формулирует обоснованный вывод.
6. «Установите соответствие»
Вариант 1.
Nа2SO4 — ……………
К2SiO3 -……………….
Ca3(PO4)2 -…………….
Ва(NO3)2 — ……………..
«Установите соответствие»
Вариант 2.
FеС13 — ……………..
ZnSO4 — ………………
АgNО3 — …………….
Fe2(SO4)3 -…………..
-
Экспресс-тест
1 вариант
|
4. Пара кислот, содержащих сложные ионы: 1. азотная и соляная 2. соляная и сероводородная 3. сероводородная и фосфорная 4. фосфорная и азотная |
|||
|
2. Установите соответствие
|
5. Установите соответствие:
| ||
|
3. При разбавлении концентрированной серной кислоты необходимо небольшими порциями приливать: 1) кислоту в воду 2) воду в кислоту |
6. Запишите определение : Кислоты … — из атомов,…и кислотных, …состоящие, …сложные вещества, …водорода, …остатков |
Экспресс-тест
2 вариант
|
4. Пара кислот, содержащих сложные ионы: 1. азотная и фосфорная 2. соляная и йодоводородная 3. сероводородная и кремниевая 4. сернистая и азотная |
|||
|
2. Установите соответствие
|
5. Установите соответствие:
| ||
|
3. Выпишите номер правильного ответа. Формула непрочной кислоты: 1) НNO3 2) Н2SO4 3) Н2CO3 4) Н3РO4 |
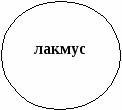
6. Какой цвет приобретает лакмус в кислоте: 1) синий 2) фиолетовый 3) красный 4) бесцветный |
«Химические страсти»
-
Группа 1 «Химические свойства Оксидов»
Выберите одно из заданий и выполните его
Группа 1 Закончите уравнения реакций
K
N
C
S
Группа 1
Из предложенного списка выберите вещества реагирующие с оксидом меди(2) : H2O, NaOН, C
Группа 1
Из предложенного списка выберите вещества реагирующие с оксидом серы(6) : H2O, NaOН, C
Группа 1
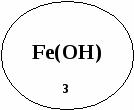
Напишите уравнения химических реакций, характеризующие химические свойства оксида железа(3)
Группа 1
Cu ↔ CuO →СиС12 → Си(NО3)2
Группа 2 «Химические свойства Оснований »
Выберите одно из заданий и выполните его
Группа 2 Закончите уравнения реакций
K
N
C
S
Группа 2
Из предложенного списка выберите вещества реагирующие с гидроксидом кальция : H2O, Na3РО4, C
Группа 2
Из предложенного списка выберите вещества реагирующие с гидроксидом железа(3) : H2O, NaOН, C
Группа 2
Напишите уравнения химических реакций, характеризующие химические свойства гидроксида железа(3)
Группа 2
Р → Р2О5 → Н3РО4 → К3РО4
Группа 3 «Химические свойства Кислот »
Выберите одно из заданий и выполните его
Группа 3 Закончите уравнения реакций
Z
H
H
H
C
Группа 3
Из предложенного списка выберите вещества реагирующие с соляной кислотой : H2O, Na3РО4, C
Группа 3
Из предложенного списка выберите вещества реагирующие с серной кислотой : H2O, Вa(OН)2, C
Группа 3
Напишите уравнения химических реакций, характеризующие химические свойства серной кислоты
Группа 3
Са → СаО → Са(ОН)2 → СаSО4
Группа 4 «Химические свойства Солей »
Выберите одно из заданий и выполните его
Группа 4 Закончите уравнения реакций
Z
H
K
C
Группа 4
Из предложенного списка выберите вещества реагирующие с хлоридом меди(2) : H2O, Na3РО4, C
Группа 4
Из предложенного списка выберите вещества реагирующие с сульфатом железа(2) : H2O, Вa(OН)2, C
Группа 4
Напишите уравнения химических реакций, характеризующие химические свойства сульфата меди
Группа 4
S → SО2 → H2SО3 → СаSО3
«Ромашка»




«Ромашка»






1 – 3 -Надо еще поработать, изучи еще раз параграфы в учебнике.
4 – 5 -Очень хорошо. Но не ограничивайте себя учебником.
5– 6 — У вас отличные знания. Но научитесь использовать их в жизни!
Рефлексия
1. Сделал дело – гуляй смело.
2. Счастье тот добывает, кто уменьем
ума набирает.
3. Работа – не волк, в лес не убежит.
4. Одна голова – хорошо, а две – лучше.
5. Что посеешь, то и пожнешь.
6. Не тот хорош, кто лицом пригож,
а тот хорош, кто на дело гож.
Оценочный лист
|
Название заданий |
Оценка ( по 5 бал. системе) |
|
|
1. |
Тестирование |
|
|
2. |
Классификация |
|
|
3. |
«Найди родственников» |
|
|
4. |
«Третий лишний» |
|
|
5. |
Экспертиза |
|
|
6. |
«Установите соответствие» |
|
|
7. |
Экспресс – тест по кислотам |
|
|
8. |
«Химические страсти» |
|
|
Итог |
|
|
Используются материалы интернета и учителей курсов
7