Казенное общеобразовательное учреждение
«Вечерняя (сменная) общеобразовательная школа 1»
г. Омска.
Конспект урока по химии
в 9 классе
«Серная кислота».
Разработала учитель химии
Климова Татьяна Владимировна.
г. Омск
2012г.
Серная кислота.
— Вы пробовали серный ангидрид
Разбавить родниковою водою?
Что проще? SO3 + H2O.
Пишу в кровати, лежа на боку.
Вот – кислота, и больше ничего,
Но, нет! Ведь там, в конце еще +Q!
И не боюсь я больше ничего,
Нет для меня загадок в этом мире.
Я к SO3 прибавил H2O,
И получил — H2SO4.
Открытый урок по химии в 9 классе
по теме «Серная кислота».
Цели урока:
Дидактическая: 1) Повторить понятие «кислоты»
2) Познакомить учащихся с особенностями серной кислоты.
3) Продолжить формирование умения составлять уравнения реакций, характеризующих химические свойства кислот.
Развивающая: 1) Развивать умение обобщать, выделять главное, делать самостоятельные выводы.
2) Развивать умение обращаться с лабораторным оборудованием.
Воспитательная: Продолжить воспитание умения слушать товарища.
Тип урока: Проблемный.
Оборудование и реактивы: 1) Штатив с пробирками, держатель, хим. стакан, стеклянная палочка, спиртовка, деревянная лучинка, кусочки бумаги.
2) H2SO4 (конц.), H2SO4 (разб.) , Zn, CuO, NaOH(р-р), BaCl2(р-р), сахарная пудра, фенолфталеин, универсальная индикаторная бумага.
Тех. Обеспечение: компьютер, мультимедиа.
Ход урока.
1. Организационный этап.
2. Целеполагание.
Цель сегодняшнего урока – повторить состав кислот и познакомиться со свойствами одного из важнейших кислородсодержащих соединений серы – серной кислотой.
В конце урока вы должны будете знать:
1) Состав серной кислоты
2) Ее действие на органические вещества.
3) Правила безопасного обращения с серной кислотой.
4) Черты сходства с другими кислотами.
5) Качественную реакцию.
6) Области применения серной кислоты.
Уметь: 1) Подтверждать все свойства серной кислоты соответствующими уравнениями реакций.
2) Проводить качественную реакцию на практике.
3) Применять полученные знания в жизни.
3. Мотивация.
Знание свойств серной кислоты необходимо не только химикам, но и простым смертным. Вот тому только один пример. На одной из железнодорожных станций в 80-е годы произошла авария, при которой на рельсы из поврежденных цистерн вылилась серная кислота. За двое суток руководство станции так и не решило проблемы нейтрализации кислоты, которая за это время «съела» рельсы, не считая экономического ущерба, который был нанесен остановкой движения. А ведь рядом со станцией работали 2 карьера: песчаный и меловой. Вы к концу урока должны будете решить эту проблему.
4. Актуализация опорных знаний. (Проводится фронтально).
Какие соединения серы вы знаете?
-
Запишите на доске формулу оксида серы (VI).
-
Какой это оксид? (основной или кислотный).
-
Запишите уравнение реакции: SO3 + H2O = ?
Как называется полученное вещество?
5. Основной этап.
1. Химическая (молекулярная) формула серной кислоты: H2SO4
2. Строение молекулы. (демонстрация на мультимедиа)
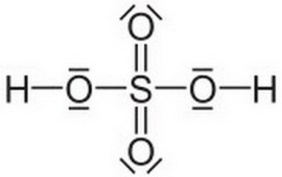
3. Физические свойства.
Учащимся предлагается рассмотреть концентрированную серную кислоту и описать ее физические свойства. После обсуждения учащиеся записывают в тетрадь физические свойства самостоятельно.
H2SO4 — бесцветная, тяжелая, нелетучая жидкость, хорошо растворимая в воде.
При растворении ее в воде происходит очень сильное разогревание. (Демонстрация: растворение конц. H2SO4 в воде).
Вывод: Приливать кислоту в воду!
4. Действие конц. H2SO4 на органические вещества.
1) Демонстрация обугливания лучинки.
Опыт: В пробирку с конц. серной кислотой опустить лучинку. Она почернеет, обуглится.
2) Демонстрация растворения кусочков бумаги, ткани.
Опыт: Погрузить в конц. H2SO4 кусочки бумаги, ткани. Они постепенно разрушаются и растворяются.
3) Демонстрация действия конц. H2SO4 на сахарную пудру.
Опыт: Насыпать в стакан на 100 мл. 15г сахарной пудры. Прилить 15 мл. конц. H2SO4 и сразу же перемешать стеклянной палочкой, так, чтобы образовалась кашица густоты сметаны. Сахар при действии H2SO4 постепенно чернеет. Затем начинается энергичная реакция между образующимся углём и H2SO4.
2 H2SO4 + С = 2Н2О +2SO2 + СО2
Образующиеся газы вспучивают обугленную массу, она поднимается и вылезает из стакана.
(Опыт проходит быстрее и эффективнее, если предварительно смочить сахар водой – температура поднимается выше).
4) Техника безопасности при обращении с серной кислотой.
При попадании на кожу – немедленно смыть большим количеством холодной воды.
4. Черты сходства разбавленной H2SO4 с другими кислотами.
1) Взаимодействие с металлами
H2SO4 + Zn = H2 + ZnSO4 (р. замещения)
2) Взаимодействие с оксидами металлов
H2SO4 + CuO = CuSO4 + H2O (р. обмена)
3) Взаимодействие с основаниями
H2SO4 +2NaOH = Na2SO4 +2H2O (р. обмена)
(Реакции 1,2,3 демонстрируют и составляют на доске уравнения реакций учащиеся под руководством учителя).
4) Качественная реакция на H2SO4.
H2SO4 + BaCl2 = BaSO4 +2HCl (р. обмена)
(Опыт демонстрирует учитель).
5. Особенности конц. H2SO4 (взаимодействие с металлами).
Конц. H2SO4 при нагревании взаимодействует почти со всеми металлами (исключение Au, Pt).
В этих реакциях в зависимости от активности металла и условий выделяются SO2, H2S, S.
Cu + H2SO4 (конц.) = CuSO4 + SO2 + 2H2O
6. Применение серной кислоты.
Учитель дает задание законспектировать применение серной кислоты и подумать над вопросом: почему серную кислоту называют «хлебом» химической промышленности?
Учащиеся смотрят слайд-шоу по мультимедиа и конспектируют в тетради области применения серной кислоты.
6. Закрепление.
1) Перечислите основные химические свойства H2SO4
2) Как бы вы поступили, имея рядом песчаный и меловой карьеры в случае, приведенном в начале урока?
(Ответ: Песок SiO2 — кислотный оксид, с H2SO4 не взаимодействует;
Мел CaCO3 — соль, а H2SO4 реагирует с солями, т.е. нужно было серную кислоту засыпать мелом.
H2SO4 + CaCO3 = CaSO4 + CO2 + H2O )
3) Для автомобильных аккумуляторов используют электролит, который готовят из концентрированной серной кислоты и дистиллированной воды. Как вы будете готовить этот раствор?
4) Самостоятельная работа по разно уровневым карточкам-заданиям.
Во время выполнения задания учитель ходит по рядам, оказывая помощь в выполнении задания слабоуспевающим учащимся.
1-й уровень: 1. С какими веществами вступает в реакцию серная кислота?
Оценка «3» 2. Закончить уравнения реакций, дать названия полученным веществам:
Вариант № 1 Вариант № 2
а) H2SO4 + Fe → а) H2SO4 + Ca→
б) H2SO4 + BaO→ б) H2SO4 + ZnO→
2-й уровень: Вариант № 3.
Оценка «4» 1. Закончить уравнения реакций, дать названия полученным веществам: а) H2SO4 + Al→ б) H2SO4 + Ca(OH)2→
2. Составьте уравнение реакции взаимодействия цинка с концентрированной H2SO4, если один из продуктов реакции SO2.
Вариант № 4.
1. Закончить уравнения реакций, дать названия полученным веществам:
а) H2SO4 + CaCl2→ б) H2SO4 + Al(OH)3→
2. Составьте уравнение реакции взаимодействия железа с концентрированной H2SO4, если один из продуктов реакции SO2.
3-й уровень: Вариант № 5.
Оценка «5». 1. С какими из перечисленных веществ будет взаимодействовать H2SO4:
Al2O3, Au, KOH, CO2, Ni.
Составьте уравнения практически осуществимых реакций.
2. Составьте уравнение реакции взаимодействия цинка с концентрированной H2SO4, если один из продуктов реакции H2S. Расставьте коэффициенты в уравнении методом электронного баланса.
7. Подведение итогов урока.
Учитель обращается к классу:
— какие цели мы ставили на сегодняшнем уроке? (если учащиеся затрудняются ответить, учитель на мультимедиа показывает эти цели).
— достигли ли мы поставленных перед собой целей?
— какие трудности возникли при изучении данного материала?
— какие вопросы не удалось освоить до конца?
— какую оценку вы бы поставили себе за работу на сегодняшнем уроке?
Литература:
-
Г.Е. Рудзитис, Ф.Г. Фельдман «Химия 9» (М. Просвещение 2009).
-
«Занимательные опыты по химии». Составитель М.И. Шкурко. Издательство «Народная Асвета» Минск 1968г
-
Сайты в интернете. Автор и источники заимствования неизвестен.