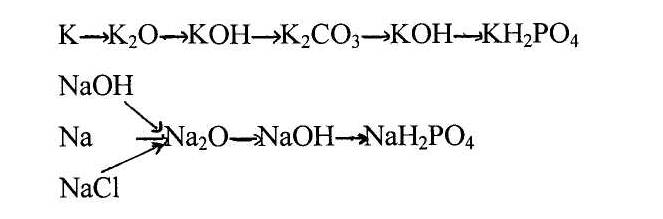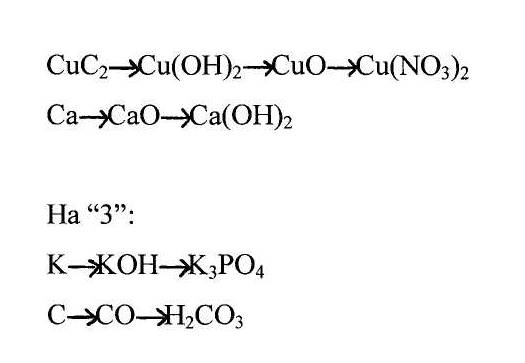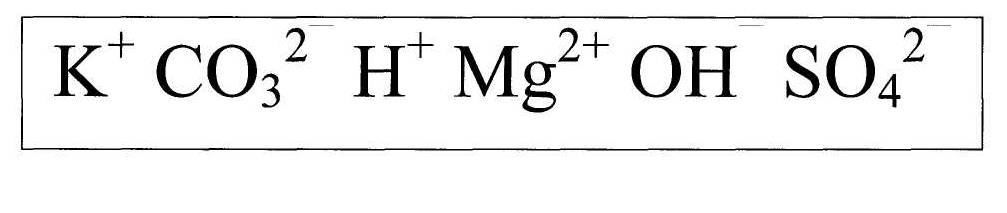Современное школьное образование призвано удовлетворить познавательные потребности учащихся, раскрыть и развить их задатки и способности, адаптировать учебный процесс к психологическим особенностям школьников, способствовать их творческому саморазвитию.
Среди нетрадиционных форм, используемых при преподавании химии , дидактические игры наиболее популярны. С одной стороны, это обусловлено психологическими особенностями подростков, с другой – программными требованиями по предмету. Использование дидактических игр на уроках контроля знаний и умений вызывает интерес и положительные эмоции, способствует предупреждению перегрузки, снимает чувство беспокойства. Эта работа разнообразна по видам и содержанию, носит во всех случаях оттенок занимательности, формирует интерес к предмету.
Игровой компонент химического образования может быть реализован при проведении уроков, экскурсий, внеклассных и факультативных занятий, исследовательских проектов и т.д. Учебная игра подразумевает активную деятельность школьников, направленную на усвоение конкретных знаний и умений и их применение в процессе достижения целей игры. Если традиционный образовательный процесс связан с передачей — получением информации, обработкой репродуктивных навыков и познавательным творчеством, то в игре участник сам ставит себе цель, ищет способы ее достижения, отбирает материал, при этом он ответственен не только за свое поведение и результаты, но и за успех всей группы.
Использование дидактических игр в обучении также дает ряд следующих дополнительных эффектов:
-
свободу: игра не задача, не долг, не закон, а свободное развлекательное действие. По приказу играть нельзя, игра идет только добровольно;
-
увлеченность;
-
возможность создать и сплотить коллектив;
-
элемент неопределенности, который возбуждает, активизирует мышление, настраивает на поиск оптимальных решений;
-
стойкий интерес к знанию, поскольку ролевые и деловые
игры создаются методом его моделирования; -
возможность развить свое мышление, поскольку необходимо
выстроить интригу и реализовать ее.
Содержание игровых технологий, используемых в учебном процессе, должно быть не случайным, а соответствовать изучаемому материалу. Основными принципами игровой деятельности.
Соответствие целям и содержанию обучения
Постоянное обогащение арсенала игр
Доступность
Разнообразие игровой деятельности
Систематичность использования и поэтапного усложнения
принципы игровой деятельности
Рациональное сочетание средств и методов в методическом обеспечении игры
Наглядность и простота структуры и технологии
Развитие общения, сотрудничества и обеспечение эмоционального климата
Активное включение учащихся в разработку сценариев, в организацию и проведение игр
Основная цель игры заключается в том, чтобы научить обучающихся творчески мыслить, перестраивать известную им информацию, достраивать задачу, развивать интуицию.
Задачи: развить познавательный интерес к химии, создать условия для комплексного использования ранее полученных знаний, научить работать в группе на общий результат, расширить кругозор.
В методике обучения основными функциями дидактической игры являются следующие:
-
образовательная, являющаяся основной, так как содержит
дидактическую цель, которая ставится в форме игровой задачи; -
воспитательная функция проявляется через воспитание
положительного отношения к предмету, желания изучать химию,
трудолюбие, трудолюбие и усердие в познании нового; в игре получают
развития такие качества личности, как сила воли, активность,
продуктивность мышления, вера в собственные силы; -
развивающая функция реализуется в тренировке памяти,
развитию интеллекта и эрудиции в процессе игры.
По характеру педагогического процесса выделяют следующие группы дидактических игр:
а) обучающие, тренировочные, контролирующие и обобщающие;
б) познавательные, воспитательные и развивающие;
в) репродуктивные, продуктивные, творческие;
г) коммуникативные, диагностические, профориентационные,
психологические и др.
Обширна технология педагогических игр по характеру игровой методики.
Укажем лишь важнейшие из применяемых типов:
-
предметные,
-
сюжетные,
-
ролевые,
-
деловые,
-
имитационные
-
игры-драматизации.
Игра — это метод обучения, требующий интенсивного участия обучаемых.
Как правило, игре предшествует подготовка слушателей, включающая теоретический курс и ряд практических занятий по отработке навыков решения задач.
Составлена картотека дидактических игр: «Периодическая система и периодический закон», «Химия и охрана окружающей среды», «Что? Где? Когда?», «Звездный час», «Отгадай химический элемент», «Развитие теории электролитической диссоциации», «Клуб находчивых химиков».
«Химический аукцион», «Химическое лото», «Химия в твоих руках», «Своя игра» и другие (смотреть приложения).
На уроках с применением игровых технологий используются также компьютерные технологии (презентации, демонстрации видеоопытов), , здоровьесберегающие технологии (физкультминутки, цветотерапия), развивающее обучение (приемы, направленные на развитие воображения, памяти, речевых навыков, мышления), проблемно-поисковые и проблемно-интегрированные технологии (постановка и решение межпредметных учебных проблем), технологии критического мышления (вызов, осмысление содержания, рефлексия) и обучения в сотрудничестве.
Результаты
Положительная динамика:
-
отношения к предмету, желания изучать химию;
-
качества знаний по химии за время реализации проекта;
-
количества (%) учащихся, повысивших итоговую оценку за последние 3 года;
-
количества (%) учащихся, подтвердивших (повысивших) годовую оценку по химии в ходе годовой и итоговой аттестации за последние 3 года.
ПРИЛОЖЕНИЕ 1
Дидактическая игра
«КЛУБ НАХОДЧИВЫХ ХИМИКОВ»
Подготовка к игре. О проведении игры – «Клуб находчивых химиков» объявляется в группе заранее, дается домашнее задание:
-
Придумать название команды (5-9 человек), выбрать капитана и девиз.
-
Игру проводит ведущий — один из студентов.
-
Подготовить интересные сообщения по теме «Классы неорганических соединений».
-
Выбирается состав жюри (4 человека) из числа студентов.
Содержание игры.
Педагог: Сегодня мы собрались в клубе находчивых химиков для того, чтобы обобщить полученные вами знания об оксидах, основаниях, кислотах, солях и получить новые. На этом занятие вы вспомните о химических свойствах важнейших классов неорганических соединений и взаимосвязях между ними. Ваши знания будет оценивать жюри.
Итак, наша игра пройдет по следующим этапам:
-
Приветствие команд.
-
Разминка.
-
Конкурс капитанов.
-
Конкурс эрудитов.
-
Проверь себя.
-
Это интересно знать.
Начинаем нашу игру.
-
Приветствие (2 балла)
-
Разминка.
1. Ведущий поочередно каждой команде задает вопросы, на обдумывание которых дается 30 сек. За каждый правильный ответ 2 балла.
а) какие вещества называются основаниями?
б) какие вещества называются кислотами?
в) какие вещества называются солями?
2. На доске представлен ряд веществ, выберите из них:
1-я команда — соли
2-я команда — основания
3-я команда — кислоты
Осуществите классификацию, дайте названия.
Выходит по одному представителю от каждой команды. На выполнение работы дается 2 минуты. Оценивается в 5 баллов.
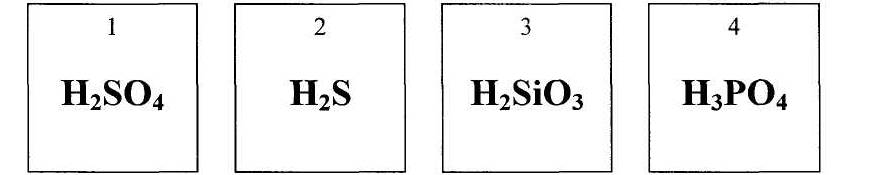
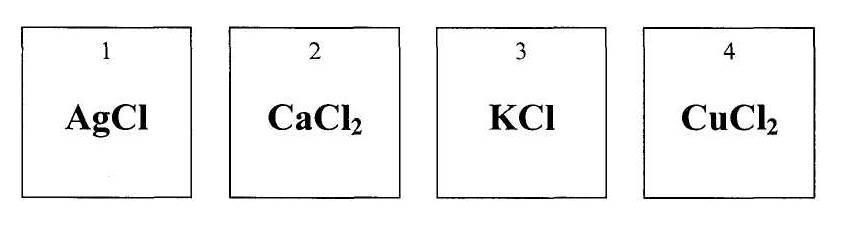
Са, Н2О, NaOH, KNO3, O3, MgCO3, КОН, НС1, Cu(OH)2, HNO3, CaHPO4.
3) С какими из перечисленных веществ будут реагировать ваши вещества? Задание выполняется на отдельном листе, каждый пишет по одному уравнению реакции, оценивается в 10 баллов, на выполнение дается 10 минут.
а) Са, NaNO3,P2O5, Сu(ОН)2, НС1, Mg, O2, КМпО4, Н2О
б) КС1, AgNO3, СиО, NaOH, HNO3, SO2, H2CO3, Mg
в) К, СО2, СаО, НС1, Си(ОН)2, Н3РО4, метиловый оранжевый, МпС12
4. Осуществить превращения.
Задание дается на карточках. За выполнение 5 баллов.
а) Na→Na2O→Na2CO3→Na2SO4
б) Cu→CuO→Cu(OH)2→CuCl2
в) S→SO2→H2SO4→ZnSO4
3. Конкурс капитанов. На выполнение дается 3 минуты и правильное выполнение оценивается в 3 балла.
1. Закончите уравнения химических реакций, расставьте коэффициенты, укажите типы реакций.
а)Н2+…=Н2О
H2SO4 + Са(ОН)2 = … + Н2О
SO3+…=H2SO4
b)Fe + HCl = FeCl2+…
CuO+…=CuSO4+H2O
Cu(OH)2=…+H2O
c)Cl2+…=FeCl2
HNO3 + … = Ca(NO3)2 + H2O
CaCl2 + Na2CO3 = … + CaCO3
2. Выявите в каждом ряду закономерность, в соответствии с которой заполнены клетки формулами разных неорганических веществ и в соответствии с правилом заполните пустые клетки подходящими формулами.
На задание дается 1 минута и оценивается 3 баллами
а)
|
NaOH |
Na2SO4 |
|
|
СаО |
|
|
б)
|
N2O5 |
HNO3 |
|
|
O2 |
|
|
|
в) |
||
|
Са |
СаО |
Са(ОН)2 |
|
|
|
NaOH |
4) Конкурс эрудитов.
1. Ведущим задаются вопросы поочередно каждой команде. На обдумывание дается 30 секунд и оценивается в пять баллов:
а) какой великий химик был поэтом, физиком, географом, геологом, стекловаром (М. В. Ломоносов)
б) какая кислота всегда находиться в желудках здоровых людей, а при недостатке этой кислоты ее употребляют как лекарство (соляная кислота)
в) какой камень искали химики средневековья, хотя такого камня в природе не было и нет ( «философский»)
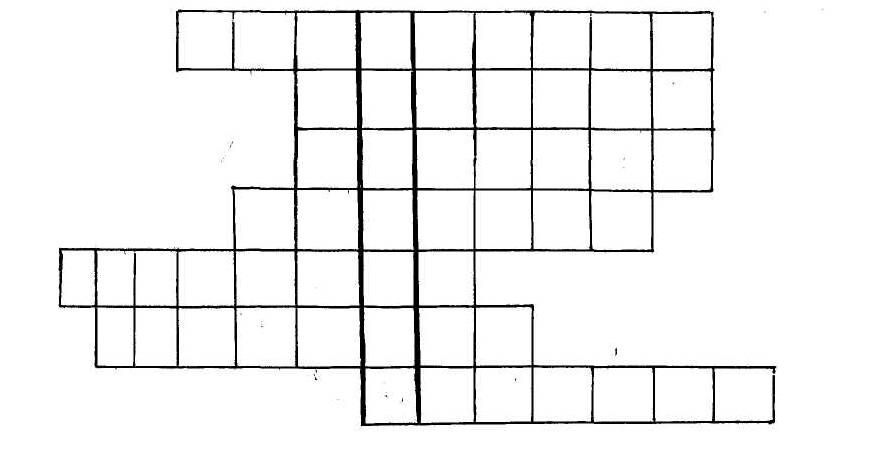
2. Решите кроссворд.
На решение кроссворда дается 5 минут и оценивается в 5 баллов. Надо заполнить клетки горизонтали так, чтобы по вертикали можно было прочитать фамилию известного композитора- химика.
-
Соли угольной кислоты.
-
Соли фосфорной кислоты
-
Соли бромоводородной кислоты
-
Соли соляной кислоты
-
Соли сероводородной кислоты
-
Соли сернистой кислоты
-
Соли азотной кислоты.
(А. Бородин)
5) Проверь себя. Ведущий предлагает карточки, помеченные разным цветом:
Красный — оценка «5»
Синий — оценка «4»
Зеленый — оценка «3»
Студент выбирает цвет карточки, и, следовательно, дифференцировано выбирает себе задание с оценкой. На выполнение дается 10 минут.
На «5» : осуществить превращения:
На «4»:
Ha «3»:
6) Это интересно знать.
Выступает один студент из каждой команды, сообщение на 1 — 2 минуты и оценивается в 5 баллов.
Заключительная часть.
Жюри подводит итоги игры и объявляет победителей.
ОТВЕТЫ К ДИДАКТИЧЕСКОЙ ИГРЕ
«КЛУБ НАХОДЧИВЫХ ХИМИКОВ»
2) 1.
А) основания – это электролиты при диссоциации которых образуется катион металла и анион только гидроксид-иона
Б) кислоты — это электролиты при диссоциации которых образуется анио кислотного остатка и катион только водорода
В) соли — это электролиты при диссоциации которых образуется катион металла и анион кислотного остатка
2. Соли: KNO3 (нитрат калия), MgCO3 (карбонат магния), CaHPO4 (гидрофосфат кальция)
Основания: NaOH (гидроксид натрия), КОН (гидроксид калия), Cu(OH)2 (гидроксид кальция)
Кислоты: НС1(соляная кислота), HNO3 (азотная кислота)
3. KNO3+ НС1 KС1+Н NO3
NaOH+ KС1 Na С1+KOH
НС1+ Cu(OH)2 Cu С12+ H2O
4. а) 4Na + O2 → 2Na2O
Na2O + Н2CO3→ Na2CO3+ H2O
Na2CO3+ Н2SO4→Na2SO4+ H2O+ CO2
б)Cu+ O2 → CuO
CuO+ H2O →Cu(OH)2
Cu(OH)2+ 2НС1→CuCl2+ H2O
в) S+ O2 → SO2
SO2+ H2O2 →H2SO4
H2SO4 +Zn (OH)2→ZnSO4+ H2O
3) 1. а)2Н2+ O2=2Н2О(соединения)
H2SO4 + Са(ОН)2 = Са SO4 + 2Н2О(обмена)
SO3+ H2O =H2SO4 (соединения)
b)Fe + 2HCl = FeCl2+ H2(замещения)
CuO+ Н2SO4=CuSO4+H2O(обмена)
Cu(OH)2= CuO +H2O (разложения)
c)Cl2+Fe=FeCl2(соединения)
2HNO3 + Cа(OH)2 = Ca(NO3)2 + 2H2O (обмена)
CaCl2 + Na2CO3 = 2Na С1 + CaCO3(обмена)
2.
а)
|
NaOH |
Na2SO4 |
|
|
СаО |
Са(ОН)2 |
Са SO4 |
б)
|
N2O5 |
HNO3 |
|
|
O2 |
H2O |
H2O2 |
|
в) |
||
|
Са |
СаО |
Са(ОН)2 |
|
Na |
Na2O |
NaOH |
4) 1. а) Ломоносов
б) соляная кислота
в) философский
2.Карбоксид, фосфаты, бромиды, хлориды, сульфиды, сульфиты, нитраты
5) К+О2=К2О
К2О+Н2О= 2КОН
КОН+Н2СО3=К2СО3+Н2О
К2СО3 +NaOH= КОН+Na2СО3
КОН+Н3РО4=КН2РО4+Н2О
4Na + O2 =2Na2O
Na2O +Н2О= 2
NaOH+Н3РО4=NaН2РО4+Н2О
CuС2+2Н2О= Cu(OH)2+С2Н2
Cu(OH)2= CuO +H2O
CuO +2Н NO3= Cu(NO3)2+H2O
2Са+О2= 2СаО
СаО+2Н2О= Са(ОН)2
К+ Н2О= 2КОН
3КОН+Н3РО4=К3РО4+3Н2О
2С+О2=2СО
СО+ H2O2 =Н2CO3
ПРИЛОЖЕНИЕ 2
Дидактическая игра
«РАЗВИТИЕ ТЕОРИИ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ»
Тип игры: ролевая
Цель игры: ознакомить обучающихся с этапами развития теории электролитической диссоциации, вызвать интерес к изучаемой теме.
Условия игры: предварительно тремя студентами подготавливаются доклады по теории растворов С. Аррениуса, по гидратной теории растворов Д. И. Менделеева и по теории электролитической диссоциации И. А. Каблукова, каждому из трёх студентов нужно в роли одного из учёных защитить положения их теории перед «научной общественностью» (классом).
Материалы: три мантии, трибуна, таблица «Схема диссоциации»
Описание игры.
Игра проходит в начале урока и рассчитана на 7-10 минут.
Преподаватель: Здравствуйте ребята, сегодня мы совершим небольшое путешествие в историю химической науки. Для этого давайте представим себе, что мы являемся научным обществом, и нам доказывают результаты своей научной деятельности выдающиеся химики разных времён.
Итак, мы переносимся в прошлое и перед нами выступает со своим докладом Сванте Аррениус, профессор университета в Стокгольме и директор Нобелевского института.
Аррениус: Уважаемое научное общество, многих интересует вопрос о том, что же происходит с солями в водных растворах, и почему эти растворы проводят электрический ток. Я считаю причиной этого является то, что молекулы солей, попадая в воду, распадаются на ионы положительно и отрицательно заряженные. Причём ионы физически равномерно распределяются между молекулами воды и никаким образом с ней не взаимодействуют. Если через такой раствор пропустить электрический ток, то «+»
ионы будут двигаться к катоду, а «-» ионы — к аноду, существованием ионов в воде обусловлены и многие другие свойства растворов.
Преподаватель: Большое спасибо Вам Сванте Аррениус за ваш доклад. А теперь мы вновь переносимся в прошлое и перед нами выступает выдающийся русский химик Дмитрий Иванович Менделеев.
Менделеев: Уважаемое научное общество, я предлагаю свою точку зрения на процессы, происходящие при растворении веществ в воде. Например, если растворить в воде аммиачную селитру, то происходит сильное охлаждение раствора, а если растворить серную кислоту, то раствор сильно разогревается. Выделение и поглощение тепла — это признаки химической реакции, значит, в растворах происходит химическое взаимодействие между ионами и молекулами воды. Я предполагаю, что при этом образуются особые соединения — гидраты – вещества, связанные с молекулами воды в определённых отношениях. Например: H2SO4*6H2O. При этом молекулы, равномерно распределённые в растворе, не являются абсолютно свободными, они связаны с молекулами воды. Гидраты можно извлечь из раствора: если сухой порошок сульфата меди белого цвета растворить в воде, то раствор окрасится с синий цвет — это признак образовавшегося гидрата. Когда мы теперь выпарим раствор, то получим кристаллы синего цвета — гидрат сульфата меди; если его прокалить, то гидратная вода испарится и кристаллы вновь станут белыми. Это и есть суть моей гидратной теории растворов.
Преподаватель: Большое спасибо Дмитрий Иванович, Ваш доклад был очень интересен. Теперь мы в третий раз мысленно попадаем в прошлое, и для зашиты своей теории приглашается Иван Алексеевич Каблуков.
Каблуков: Уважаемое научное общество, две представленные научные теории различаются между собой и в чём-то противоречат друг другу. Я предлагаю объединить их и развить в новую теорию электролитической диссоциации. Суть её в следующем:
-
молекулы многих веществ, при растворении в воде, под действием
молекул воды распадаются на ионы; -
ионы, в свою очередь, взаимодействуют с молекулами воды и образуют гидратированные ионы так, как представлено на этой схеме (демонстрирует схему);
-
растворение — это одновременно и химический и физический процесс, в результате которого ионы распределяются между молекулами воды, и взаимодействуют с ними.
Преподаватель: Большое спасибо Ивану Алексеевичу за доклад. А теперь научное общество вновь становится обычными студентами. И сейчас вы ответите на несколько вопросов:
-
Скажите, пожалуйста в чём различия теорий Аррениуса и Менделеева?
-
В чём состоит заслуга И. А. Каблукова?
По результатам опроса преподаватель одобряет студентов, их наблюдательность и внимание. Благодарит исполнителей ролей учёных.
ПРИЛОЖЕНИЕ 3
Познавательная викторина
«ОТГАДАЙ ХИМИЧЕСКИЙ ЭЛЕМЕНТ».
Добавьте к названию…
-
… города Руби в США три буквы в конце слова, и вы получите на
звание химического элемента, применяемого в фотоэлементах, лампах дневного света. (Рубидий.) -
… города Сере в Греции три буквы в конце слова, и вы получите
название химического элемента, который алхимики считали связанный с Луной. (Серебро.) -
… реки Фрай, протекающие в Юго-Восточной Азии, три буквы в
середине слова, и вы получите название химического элемента, который выделен французской исследовательницей М.Порей и назван в честь ее родины.
(Франций.) -
… река Цин, протекающей в Палестине, только одну букву в конце
слова, и вы узнаете название химического элемента, который входит в состав
латуни. (Цинк.) -
… города Бай в Восточном Казахстане две буквы в середине слова,
и вы получите название химического элемента, применяемого в производстве
красок, стекла, эмалей. (Барий.) -
… города Гали в Грузии две буквы: одну в середине слова, другую
в конце слова, и вы получите химический элемент; название которому дал
француз, наследник древних галлов Л. де Буабодран. (Галлий.) -
… крупной реки, протекающей в Пакистане, две буквы в конце
слова, и вы получите название химического элемента, который входит в состав антикоррозийных покрытий и используется в полупроводниковой технике. Он был открыт в 1863 г. с помощью спектроскопии цинковой обманки Ф.Райхом и Р.Рихтером (р. Инд — индий.) -
… косметической мази три буквы в конце слова, и вы получите на
звание химического элемента, применяемого в электронике. (Крем — кремний.) -
… города Ман в Кот-Дивуаре Юго-Западной Африки три буквы в
начале и две в конце слова так, чтобы получилось название химического элемента, который открыт химиком К.Винклером в 1886 г. Этот элемент Д.И.Менделеев назвал экасилицием. (Германий.) -
… вида искусства четыре буквы в конце слова, и вы получите на
звание химического элемента IV группы периодической системы химических
элементов Д.И.Менделеева. (Цирк — цирконий.) -
… города Сур в Ливане три буквы и получите название химического элемента, латинское название которого «стибиум». (Сурьма.)
-
… река в Северо-Восточной Франции одну букву в конце слова, и
вы получите название «адского» элемента. (Сера.) -
… города Рен во Франции две буквы в конце слова, и вы узнаете
название химического элемента, открытого немецкими химиками Вольтером и
Идой Ноддак в 1927 г. и названного в честь их родины. (Рений.) -
… сладкого студенистого кушанья, приготавляемого из фруктовых соков с желатином, две буквы в конце слова, и вы получите название химического элемента, который алхимики считали связанным с Марсом. (Желе — железо.)
-
… города Род в Швеции две буквы в конце слова, и вы получите
название химического элемента. Оно происходит от греческого «роза». (Родий.) -
… озера Кри в Канаде четыре буквы в конце слова и узнаете название химического элемента, применяемого в электровакуумной технике. (Крип
тон.)
• … самой главной реки в Ростовской области две буквы так, чтобы
получилось название химического элемента, который образуется при радиоактивном распаде радия, (р. Дон — радон.)
Превратите в название химического элемента…
-
… город Ат. Этот элемент арабские алхимики называли «натрон».
(Натрий.) -
… название застывшего клейкого сока некоторых растений, используемого в промышленности и медицине, убрав из него название реки, протекающей во Вьетнаме. Название этого элемента, по мнению алхимиков, связано с Венерой. (Камедь — р. Камедь.)
-
… город Берли. Этот элемент — «сосед» лития. (Бериллий.)
-
… реку Ма. Этот элемент был получен в 1808 г. английским химиком Г.Дэви. (Магний.)
-
… город Киль. Этот элемент один из самых распространенных на
Земле. (Кальций.) -
… реку Итури. Этот элемент относят к редкоземельным. (Иттрий.)
-
… город Угледар. Из атомов этого элемента состоит грифель карандаша. (Углерод.)
-
… остров Ган. Этот элемент открыт в 1923 г. датскими учеными
Д.Костером и Д.Хевеши в Копенгагене. (Гафний.) -
… город Сине. Латинское название элемента «плюмбум». (г. Сине — свинец.)
-
… реку Кура. Этот элемент назван в честь выдающегося ученого,
организатора работ по освоению атомной энергии. (Курчатовий.) -
… город Соро. Этот элемент применяется в производстве спичек,
для получения сплавов, полупроводниковых материалов. (Фосфор.) -
… реку Обь. Этот элемент назван в честь дочери Тантала. (Ниобий.)
-
… имя одного из легендарных братьев, основавших Рим. Этот элемент был открыт в 1797 г. французским химиком Л.Вокленом в минерале кро-
коите. (Ромул или Рем — хром.) -
… город Мол. Этот микроэлемент используется в производстве легированных сталей, сплавов для авиастроения, а также в электро- и радиотехнике. (Молибден.)
-
… название полезного ископаемого, переставив в нем две буквы.
Этот элемент был открыт в 1886 г. французским химиком Анри Муассаном.
(Торф — фтор.) -
… бобовое растение. Этот элемент был выделен в 1844 г. профессором Казанского университета К.К.Клаусом и назван в честь России. (Нут —
рутений.) -
… остров Осима. Этот элемент получен в 1804 г. С.Теннантом.
(Осмий.) -
… город Кота. Этот элемент образует много комплексных соединений. Его название в переводе с немецкого означает «домовой» или «гном».
(Кобальт.) -
… реку Ирири. Это стабильный химический элемент. (Иридий.)
-
… город Кинель Самарской области. Этот элемент был открыт в
1751 г. шведским химиком А.Кронстедтом. (Никель.) -
… сухую траву. Простое вещество, образованное атомами этого
элемента, представляет собой инертный газ. (Сено — ксенон.) -
… самого крупного грызуна, обитающего в России. (Бобр — бор.)
-
… название семейства ящериц, обитающих преимущественно в
тропиках Восточного полушария. (Сцинки — цинк.) -
… героев древнегреческой мифологии отправившихся в Колхиду за
золотым руном. (Аргонавты — аргон.)
Замените в названии...
-
… химического элемента, который назван по имени малой планеты
Церера, одну букву, и вы узнаете название химического элемента, открытого в
1860 г. Р.Бунзеном и Г.Кирхгофом с помощью спектрального анализа. (Церий — цезий.) -
… города Лантуй две последние буквы, и вы получите название
химического элемента, открытого в 1839 г. К.Мосандером. (Лантан.) -
… животного, относящегося к типу кишечнополостных, одну букву, и вы получите название радиоактивного химического элемента. (Актиния —
актиний.) -
… города Олой две буквы, и получите название химического элемента, применяемого для изготовления белой жести. (Олово.)
-
… города Вольфен в Германии две последние буквы, и вы узнаете
«короля» тугоплавкости. (Вольфрам.) -
… географической области Прикарпатья Полонины две последние
буквы так, чтобы получилось название химического элемента, который выделен в 1898 г. супругами Кюри и назван в честь родины Марии Склодовской-
Кюри. (Полоний.) -
… города Брум в Австралии одну букву, и вы получите название
химического элемента, в переводе с греческого означающего «зловонный».
(Бром.) -
… реки Йом в Таиланде последнюю букву, и вы узнаете название
химического элемента, который содержится в морских водорослях и в переводе с греческого означает «фиолетовы» (Йод.) -
… избыточно увлажненного участка земной поверхности первую
букву, и вы получите название химического элемента. (Болото — золото).
Так называют и химический элемент, и…
-
… гиганта в древнегреческой мифологии, вступившего в борьбу в
богами, и человека огромных творческих возможностей, и большой кипятильник для воды. (Титан.) -
… город в Днепропетровской области. (Марганец.)
-
… планету, и реку, и бога неба в греческой мифологии. (Уран.)
-
… желтое вещество, образующееся в ушном канале, и минерал.
(Сера.)
ПРИЛОЖЕНИЕ №4
Дидактическая игра
«ЗВЁЗДНЫЙ ЧАС»
Цель: проконтролировать и обобщить знания обучающихся по теме «Электролитическая диссоциация»
Материалы: напольное игровое поле из пяти дорожек, каждая из которых состоит из пяти этапов (выделены разным цветом), таблички с цифрами от 1 до 8 — 10 комплектов, кубики с нарисованными ионами — 10 штук, таблички, доска, звёзды.
Игру проводит один из студентов, в игре принимают участие 5 игроков, выбираются 3 помощника, в состав жюри входят 3 студента.
Описание хода игры.
Игра проходит в 4 тура. Составляются команды по два человека. Один из игроков (№1) располагается на игровой дорожке, состоящей из пяти уровней. Второй игрок (№2) команды находится прямо за своим напарником за столом. Всего пять команд. Задача игроков — правильно отвечать на вопросы ведущего. За каждый правильный ответ игрок № 1 перемешается по игровой дорожке на один уровень вперёд. Если правильно отвечает и игрок №2, то команда получает ещё и звезду. Победителем тура считается команда, у которой игрок № 1 прошёл все пять уровней и заработано больше звёзд. Во второй тур проходят первые четыре команды. В третий — первые три, в четвёртый — только две. Между третьим и четвёртым туром проходит игра со зрителями. Когда игрок одним из первых дошёл до финиша, он может отвечать на вопросы и зарабатывать звёзды. Перед четвёртым туром подсчитываются звёзды, команда, у которой больше звёзд получает столько звёзд, насколько их у команды было больше. В четвёртом туре двум командам предлагается из набора ионов составить как можно больше соединений. Команда, у которой остались звезды, может использовать одну звезду вместо одного иона. Победителем считается команда, составившая больше формул.
Содержание игры
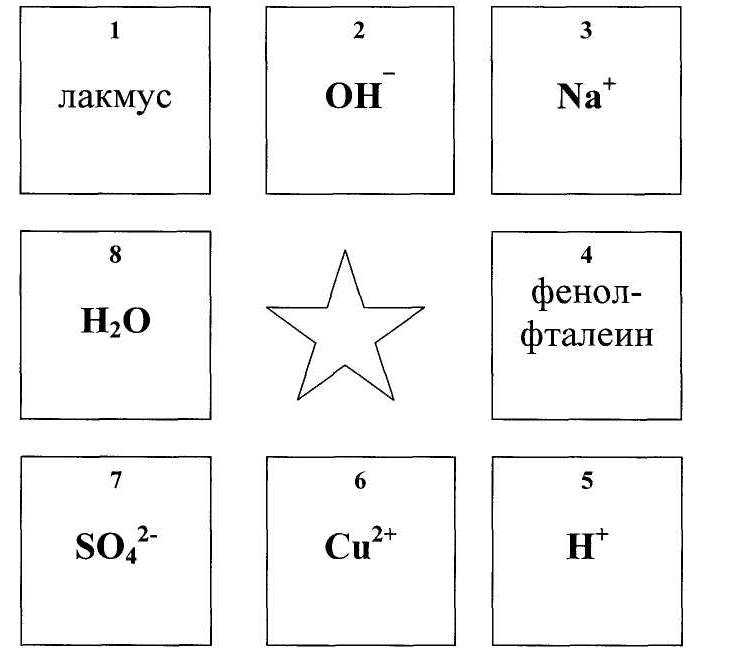
Первый тур — необходимо из восьми вариантов выбрать один правильный и поднять табличку с номером.
Вопросы первого тура:
-
Какой ион входит в состав всех кислот?
-
Какие два иона образуют нерастворимое в воде соединение?
-
При добавлении какого вещества раствор кислоты окрасится в
красный цвет? -
При добавлении какого вещества раствор щелочи окрасится в
синий цвет? -
На каких табличках изображены ионы металлов?
-
Какой ион окрашивает раствор медного купороса в синий цвет?
-
Какой ион присутствует в растворе всех щелочей?
-
Какой ион образует всегда растворимые соединения?
9. На какой табличке изображена формула воды?
10.Какие два иона образуют кислоту?
11 .Какие два иона образуют щелочь?
12. С каким ионом взаимодействует фенолфталеин?
Задания второго тура.
-
Расположите кислоты в порядке увеличения их летучести.
-
Расположите кислоты в порядке увеличения их констант
диссоциации по первой ступени.
-
Расположите данные соли в порядке уменьшения их относительной
молекулярной массы. -
Расположите эти соли в порядке увеличения их растворимости.
-
Расположите вещества с таком порядке: основание, кислая соль,
основная соль, средняя соль.
-
Укажите одну из пар веществ, при смешении которых в растворе
произойдет реакция нейтрализации.
Задание третьего тура.
На игровое поле бросают 10 кубиков, на гранях которых изображены различные ионы. Задача участников: написать полное ионное, сокращённое ионное и молекулярное уравнения реакции с участием этих ионов, идущей до конца за 2-3 минуты. Если уравнение игрока № 1 совпадает с уравнением игрока № 2, то команда получает звезду. Выигрывают первые две команды, правильно написавшие все три уравнения.
Игра со зрителями.
Зрителям также предлагается составить такие же уравнения. Выигрывает первый правильный ответ.
Подписанные листы с ответами собираются и у игроков и у зрителей помощниками ведущего.
Задание для четвёртого тура.
Составьте как можно больше формул веществ из предложенных ионов.
В конце игры победители, а также те, кто этого достоин, по мнению жюри, получают призы и положительные оценки.
ОТВЕТЫ К ДИДАКТИЧЕСКОЙ ИГРЕ
«ЗВЁЗДНЫЙ ЧАС»
1тур
1-5
2-6,7
3-1
4-1
5-3,6
6-8
7-2
8-3
9-8
10-5,7
11-2,6
12-2
2тур
-
3,4,1,2
-
3,4,2,1
-
1,4,2,3
-
1,4,2,3
-
3,2,1,4
-
3,4
4тур
К2СО3,КОН, К2SО4, Н2СО3, МgСО3,Н2О,Н2SО4, Мg(ОН)2
ПРИЛОЖЕНИЕ 5
Дидактическая игра
«ЧТО? ГДЕ? КОГДА?»
Игра проводится как зачет.
Подготовка к игре. Выбирается команда из 7 игроков, один ведущий, остальные подбирают вопросы по теме «Связь химии с другими науками» для игры. Вопросы, отобранные для игры, помещают в отдельные конверты и объединяют по блокам (например, химия и языкознание, химия и литература, химия и математика, химия и физика, химия и биология). На лицевой стороне каждого конверта крупным шрифтом указывается число баллов, которыми данный вопрос оценивается, а на обратной — фамилия и имя автора вопроса. За каждый из предложенных вопросов студенты получают по 10 баллов. Перед игрой конверты укрепляют над доской в местах, отведенных для соответствующих блоков. Для игры изготовляется игровое поле, разделенное на пронумерованные секторы, число которых соответствует числу студентов в группе, и волчок со стрелкой.
Проведение игры. Право выбора конверта студенты разыгрывают между собой при помощи игрового поля. Студент, на которого показала стрелка волчка, выбирает конверт и отвечает на вопрос. За правильный и полный ответ он получает максимальное число баллов написанное на конверте, за неточный и неполный — меньше. Если студент, вскрывший конверт, затрудняется с ответом, слово предоставляется любому другому участнику. Если правильных ответов нет, отвечает автор вопроса и тогда он получает максимальное число баллов.
Подведение итогов. Участник игры, набравший наибольшее число баллов, становиться победителем. Студентам, получившим более 200 баллов, ставим отметку «5», 150-200 баллов — «4», 50-149 — «3». Содержание игры.
1. Химия и языкознание
1) В русском названии какого элемента, состоящего из 7 букв, только 2 буквы не повторяются? (25 баллов)
Ответ. Водород.
2) Переведите на русский язык с английского следующее предложение: «Under usual conditions hydrogen is a colourless and an odourless gas». (25 баллов)
Ответ. При обычных условиях водород — газ без цвета и запаха.
3) Соответствует ли современным представлениям название химического элемента кислорода? (50 баллов)
Ответ. Название кислороду Oxyggenium дал французский химик А. Лавуазье, который считал обязательной составной частью всех кислот (oxys — кислый, gennao — рождаю, т. е. рождающий кислоты). Название не отвечает современному уровню химических знаний, так как имеется большая группа бескислородных кислот.
2. Химия и литература
1) В одном из сочинений поэтессы В. Инбер есть такие слова: «Подобно тому как кислород и азот, соединяясь, составляют воздух, необходимый для жизни, — точно так же мысль и чувство… образуют воздух, которым дышит поэзия». Права ли поэтесса, говоря о воздухе, как о соединении азота с кислородом? (25 баллов)
Ответ. В состав воздуха входят не только кислород и азот, составляющие большую часть воздуха, но и водород, углекислый газ.
2) В романе писателя — фантаста А. П. Казанцева «Пылающий остров» рассказывается об обнаружении на одном из островов газа, в присутствии которого для начала реакции азота с кислородом достаточно зажечь спичку. Сам же газ при этом не расходуется. Действие романа развертывается в борьбе меду злыми силами, стремящимися с помощью этого газа уничтожить ряд стран, и учеными, противодействующими этому. Какова роль упомянутого газа в реакции азота с кислородом? (25 баллов.)
Ответ. Катализатор.
3) В произведении Л. Буссенара «Похитители бриллиантов» есть такие слова: «Известно, что рудничный газ, или углеводород, обладает свойством воспламеняться под действием света и, смешиваясь в определенной пропорции с атмосферным воздухом, дает мощный взрыв». Какой газ имел в виду писатель? Напишите уравнение горения этого газа. (50 баллов.)
Ответ. СН4 + 2О2 →СО2 + 2Н2О
3. Химия и математика.
1)Составьте формулу оксида алюминия. (25 баллов.)
Ответ. А12Оз
2) Вычислите массовую долю (в %) кислорода в оксиде серы IV. (50 баллов)
Ответ. 50%
-
Найдите массовые отношения элементов в серной кислоте. (25 баллов)
Ответ. 0,02 : 4 : 0,65
4. Химия и физика
1) Можно ли заполнить газообразным кислородом полбаллона? (25 баллов)
Ответ. Нет, он распределится по всему баллону.
2) Почему молекулы входящих в состав атмосферы газов, двигаясь во все стороны, не покидают землю, не улетают в космическое пространство? (50 баллов)
Ответ. Чтобы покинуть Землю, газообразные вещества должны преодолеть силу земного тяготения. А это возможно лишь в том случае, когда движения их молекул скорость будет не менее 11,2 км/с.
3) Подъемная сила водорода больше подъемной силы гелия. Но для наполнения шаров более удобен гелий. Почему? (25 баллов.)
Ответ. Гелий проще получить.
5. Химия и биология
1) С какой целью проводиться рыхление почвы? (25 баллов)
Ответ. В процессе рыхления усиливается доступ кислорода из воздуха и уменьшается испарение воды из верхнего слоя почвы.
2) Почему под слой почвы в парниках и теплицах закладывают навоз? (25 баллов)
Ответ. При гниении выделяется теплота, обогревающая почву, и образуются вещества, необходимые растениям для питания.
3) Почему запрещается пасти скот, собирать грибы и ягоды в зеленой зоне, прилегающих к автомагистрали? (25 баллов)
Ответ. Автомобильные выхлопы, содержащие оксид углерода (11), оксиды азота, соединения свинца и другие ядовитые вещества, накапливаются растениями и могут вызвать отравления человека и животных.
2. Поместить на предметное стекло каплю полученного раствора,
закрепить стекло держателем.
3. Выпарить над спиртовкой каплю раствора до образования кристаллов сульфата меди (П).
4. Объяснить наблюдаемые явления, написать уравнения реакций,
указать тип химической связи в молекуле сульфата меди (II).
Задание №9
Ответы: 1. Хлор. 2. Кислота. 3. Менделевий. 4. Калий. 5. Щелочь. 6. Сера. 7. Масса. 8. Электроотрицательность. 9. Ионы. 10. Нейтроны. 11. Экасилиций. 12. Металлы. 13. Электроды. 14. Атомная. 15. Нептуний. 16. Ионная,17. Изотопы.
Ключевое слово: ХИМИЧЕСКИЙ ЭЛЕМЕНТ.
Задание №10
1-2-7-8-4-9-14-18-23-19-20
ПРИЛОЖЕНИЕ 6
Дидактическая игра
«ХИМИЯ И ОХРАНА ОКРУЖАЮЩЕЙ СРЕДЫ»
Для проведения игры необходимы фишки любой формы с числами 10, 20,30, 40, 50, 60, 80, 100 и таблицы для синего и красного раундов (табл. 1 и 2).
Синий раунд Таблица 1
|
Охрана природы |
Отходы в доходы |
Неметаллы |
Вода |
|
|
10 |
10 |
10 |
10 |
10 |
|
20 |
20 |
20 |
20 |
20 |
|
30 |
30 |
30 |
30 |
30 |
|
40 |
40 |
40 |
40 |
40 |
|
50 |
50 |
50 |
50 |
50 |
Красный раунд Таблица 2
|
Нефть |
Выхлопные газы автомобилей |
Кислородсодержащие органические соединения |
Азотсодер-жащие органичес-кие вещества |
|
|
20 |
20 |
20 |
20 |
20 |
|
40 |
40 |
40 |
40 |
40 |
|
60 |
60 |
60 |
60 |
60 |
|
80 |
80 |
80 |
80 |
80 |
|
100 |
100 |
100 |
100 |
100 |
Студенты делятся на три команды по 5-6 человек. Команды называют тему и цену вопроса в баллах. Ассистент закрывает названное число в таблице, а ведущий зачитывает задание. На обсуждение ответа дается 15 с. Команды отвечают по очереди. При правильном ответе команда получает фишку с выигранном числом баллов, при неправильном – штраф на данное число баллов.
Если выпадает «Кот в мешке», команда передает вопрос одному из соперников по своему выбору. В туре «Своя игра» команды обдумывают ответ 20с. Цену вопроса назначают сами (исходя из набранного количества очков), имея право увеличить или уменьшить ее. Цену записывают на листке бумаги. На этом же листке команды пишут вариант ответа. Листки с ответами ассистент передает ведущему. Ведущий зачитывает правильный ответ и подводит итоги игры.
Синий раунд
Экологический словарь
10 баллов. Твердые или жидкие частицы, находящиеся в атмосфере и образующие туман или дым. (Аэрозоль.)
20 баллов. Естественное или искусственное поступление воздуха в воду, почву, горные породы. (Аэрация.)
30 баллов. «Своя игра». Вещества, применяемые для уничтожения растений, в частности для борьбы с сорняками. (Гербициды.)
40 баллов. Радиоактивные вещества, тяжелые металлы, техногенные химические соединения, способствующие появлению злокачественных опухолей. (Канцерогены.)
50 баллов. Смесь газов, которая образуется из органических остатков, насыщенных органическими веществами илов, бытовых отходов. (Биогаз: CH4 , CO2, H2, O2, H2S.)
Охрана природы
10 баллов. Атмосферные осадки, содержащие кислоту. (Кислотные дожди.)
20 баллов. Повторяющиеся процессы превращения веществ, перемещения атомов, молекул, природных вод, минеральных масс в биосфере. (Круговорот веществ.)
30 баллов. Соли азотной и азотистой кислот, которые могут накапливаться в воде и пищевых продуктах, вызывая тяжелые заболевания. (Нитраты и нитриты.)
40 баллов. «Кот в мешке». Тема «Оксиды», 20 баллов. Природное явление, вызванное поглощением углекислым газом, водяным паром энергии солнечных лучей. (Парниковый эффект.)
50 баллов. Повышение содержания в почве легкорастворимых солей, угнетающих рост растений и подавляющих почвенную фауну и флору. (Засоление почв.)
Отходы в доходы
10 баллов. «Кот в мешке». Тема «Кислоты», 60 баллов. Эту кислоты получили в 1784 г. из цитрусовых. В настоящее время применяется более дешевое сырье – свекла. Кислота используется как пищевая добавка. (Лимонная кислота.)
20 баллов. Часть природного сырья, которая не используется или остается после переработки и использования. (Отходы.)
30 баллов. Оксид углерода, который применяется в качестве теплоносителя в ядерных реакторах. (Углекислый газ.)
40 баллов. Недостижимый идеал, к которому следует стремиться промышленным, транспортным, сельскохозяйственным предприятиям. (Безотходная технология.)
50 баллов. Наука, изучающая технические системы, а также химическое загрязнение окружающей среды в результате техногенеза. (Техногеохимия.)
Неметаллы
10 баллов. «Своя игра». Геофизик М. И. Будыко еще в 1962 г. предположил, что сжигание человечеством огромного количества топлива приведет к повышению содержания этого оксида в воздухе. Назовите оксид. (Оксид углерода (IV).)
20 баллов. Эффект, последствием которого многие климатологи считают мягкие зимы конца 80-х – начала 90-х гг. ХХ в. (Парниковый эффект.)
30 баллов. Организмы, фиксирующие в природе молекулярный азот. (Клубеньковые бактерии бобовых растений.)
40 баллов. В связи с уменьшением выброса этого токсичного газа предприятиями энергетического комплекса содержание его в воздухе летом в 2-5 раз ниже, чем зимой. (Оксид азота (IV).)
50 баллов. Оксиды, катализирующие разрушение озонового слоя. (Оксиды азота (II) и (IV).)
Вода
10 баллов. Глобальный гидрологический цикл имеет три основных потока: осадки, влагоперенос и …(Испарение.)
20 баллов. Какое воздействие на растительность водоемов оказывает поступление большого количества удобрений со сточными водами? (Начинается чрезмерный рост водорослей.)
30 баллов. Загрязнители, попадающие в природные воды из атмосферы с осадками. (Серная и азотная кислоты, сульфаты, нитраты и др.)
40 баллов. Метод очистки воды с участием микрофлоры активного ила. (Биологическая очистка.)
50 баллов. «Своя игра». Почему при наличии в сточных водах большого количества трудно окисляемых органических веществ нежелательно применение озона для их очистки? (Возможно образование продуктов неполного окисления, причем более токсичных, чем исходные органические соединения.)
Красный раунд
Углеводороды
20 баллов. Газ, образующийся в результате анаэробной ферментации клетчатки в пищеварительном тракте некоторых животных. (Метан.)
40 баллов. «Своя игра». Соединения, от которых природный газ очищают путем адсорбции их сильными основаниями. (Сероводород, сернистый газ.)
60 баллов. Смесь водорода и оксида углерода (II), получаемая при паровой конверсии метана. (Синтез-газ.)
80 баллов. Биологическая переработка органических отходов. (Конверсия.)
100 баллов. Для чего в некоторых странах свалки мусора специально оборудуют особыми мембранами и дренажной системой? (Для получения биогаза.)
Нефть
20 баллов. Какие двигатели являются экологически более безопасными? (Дизельные.)
40 баллов. Сколько примерно веществ содержится в выхлопных газах двигателей внутреннего сгорания ? (Около 200, причем большинство из них токсичны.)
60 баллов. При каком режиме работы двигателей концентрация вредных веществ в выбросах резко увеличивается? (На холостом ходу.)
80 баллов. Явление, представляющее угрозу для здоровья человека, обусловленное выбросами выхлопных газов автомобилей и газовых отходов производства. (Смог.)
100 баллов. «Кот в мешке». Тема «Озоновый слой», 20 баллов. Вещества, используемые в аэрозольных баллончиках, являющиеся источником катализаторов разрушения озонового слоя. (Фреоны.)
Кислородсодержащие органические вещества
20 баллов. При сгорании в автомобильных двигателях эти спирты дают значительно меньше вредных веществ, чем традиционное моторное топливо. (Метанол и этанол.)
40 баллов. Спирт, потребление которого даже в небольших количествах вызывает потерю зрения и смерть. (Метанол.)
60 баллов. «Кот в мешке». Тема «Целлюлоза», 100 баллов. Смесь органических веществ, образующаяся при сульфитном способе производства бумаги. (Сульфитный щелок.)
80 баллов. Одно из органических веществ, попадающее в окружающую среду в составе сточных вод целлюлозно-бумажных комбинатов, очень токсично. (Фенол.)
100 баллов. В литературе описаны случаи взрыва пустой бутылки из-под диэтилового эфира при попытке ее открыть. Почему это происходит? (В бутылке могут находиться пары эфира, из которых образуются взрывоопасные пероксиды.)
Азотсодержащие органические вещества
20 баллов. «Вопрос-аукцион». Выращивая микроорганизмы на питательной среде, полученной из нефти, можно получить это вещество. (Белок.)
40 баллов. Соль одной из аминокислот, пищевая добавка. (Глутамат натрия.)
60 баллов. Вещество, содержащее пептидную связь, в 200 раз слаще сахара. (Аспартам.)
80 баллов. «Кот в мешке». Тема «Металлы», 80 баллов. В организме северных оленей содержание ртути в 10-100 раз больше, чем в организмах животных умеренных широт. Это обусловлено способностью некоторых растений концентрировать тяжелые металлы. Какие это растения? (Мхи.)
100 баллов. Это лекарство способно угнетать процессы размножения вируса ВИЧ. (Азидотимидин.)
ПРИЛОЖЕНИЕ 7
Дидактическая игра для контроля знаний в 8 классе
«ПЕРИОДИЧЕСКАЯ СИСТЕМА И ПЕРИОДИЧЕСКИЙ ЗАКОН Д.И. МЕНДЕЛЕЕВА»
В процессе изучения периодической системы Д.И.Менделеева можно использовать вербальные игры, которые не требуют долгих приготовлений и сложных атрибутов. Их можно использовать вместо эпиграфа в начале занятия, а также на всех последующих этапах обучения. К вербальным дидактическим играм относятся: анаграммы, логогрифы, метаграммы, шарады, криптограммы, загадки, ребусы, кроссворды, чайнворды, викторины и т.д.
Анаграммы.
Буквы лежат на столе перед вами.
Расставьте их так, чтобы стали словами.
Первое слово — фигура одна,
Всего в ней, заметьте, четыре угла.
Слово второе сумейте собрать —
Красно-бурою жидкость вам надо назвать.
(Ромб — бром.)
Я — газ редчайший на Земле.
Мне близки радий и свинец.
Но если переставить буквы мне,
То я уже — истории творец.
(Радон — народ.)
Я — энергии источник.
И сказать могу вам точно:
«Сумел Клапрот меня открыть,
Эжен Пел иго — получить».
Но ели буквы переставить
И в углу меня поставить,
Буду стойко там стоять
Молча мусор собирать.
(Уран — урна.)
Горючий продукт я,
«Живу» на болотах.
Но есть одна буква
В названье коротком.
Прыжок ее быстрый —
И все изменилось:
Я стал элементом.
Так чудо свершилось!
(Торф — фтор.)
Логогрифы.
Придумайте внимательно,
Чтоб слово отгадать.
Я — как круг спасательный,
Попробуйте назвать.
Если Ф в конце добавить.
На болоте окажусь,
Если Ф вперед поставить,
В неметалл я превращусь.
(Тор — торф — фтор.)
В свободном виде он всех убивает,
Если «связать», то в еду добавляют.
Но ежели в слове мы Л зачеркнем,
То дружно со всеми мы песню споем.
(Хлор-хор)
Я — металл, меня ты знаешь.
Мощь громадная во мне.
Но если Б ко мне поставишь,
То землю скрою в темной мгле.
(Уран — буран).
Три элемента с одним окончанием
Вас для начала прошу я найти…
Если отбросить теперь окончания,
Новых три слова получите вы.
Первое слово с детства мы любим.
Слово второе — ловкач и хитрец.
Третье — настил, по которому ходим.
Кто разгадал, тот у нас — молодец.
(Цирконий, плутоний, полоний — цирк, плут, пол.)
Двенадцать пар — не забывай! –
У всех людей на свете.
В другом значенье — узкий край,
Так учат в школе дети.
Но если СЕ ко мне прибавить,
То вмиг в металл я превращусь.
Еще к тому могу добавить,
Что в первой группе окажусь.
(Ребро — серебро.)
Метаграммы.
Два элемента химических
В метаграмме я вам загадал:
С X — элемент металлический,
А с Б — я уже неметалл.
(Хром — бром.)
Элемент IV группы
Перед всеми на виду.
Если Т на Р исправить,
Будет деспот наяву.
(Титан — тиран.)
Менделеев впервые меня предсказал.
Французский ученый — название дал.
Если в нем первую букву заменишь,
Место в системе мне сразу изменишь.
(Галлий — таллий.)
Живут два брата в микромире,
Свойства их полезно знать.
У А — восьмерки на квартире,
У О — квартира сорок пять.
(Радий — родий.)
С КА — активный я металл,
С ГЕ — я очень легкий газ.
Чтобы нас ты разгадал,
Глянь в систему еще раз.
(Калий — гелий.)
В нем воды течет спокойно,
Здесь насосы не нужны.
Но если Р поставить в слово,
Вещество получишь ты.
Вещество то всем известно –
Газ летучий на Земле.
А сказать я должен честно:
Мы сменили букву В.
(Водовод — водород.)
Шарады.
К предлогу и ноте
Время года добавьте.
Из всех этих букв
Лантаноид составьте.
(Под, ре, зима — празеодим.)
Основа моя — сухая трава,
С обоих концов — согласные.
В целом я — газ, дорогие друзья,
И название, думаю, ясно вам.
(К, сено, н — ксенон.)
Первый снег — предлог известный.
Слог второй трудней найти:
Часть его составит цифра,
К ней добавьте букву Й.
Чтобы целое узнать,
Нужно вам металл назвать.
(На, три, й — натрий.)
Найдите две ноты в начале октавы:
Участок, где выросли сочные травы.
Из букв этих слов элементов название,
Подумав, попробуйте быстро составить.
Чудесными свойствами он обладает:
То ярко сверкает, то черным бывает.
(До, ре, луг — углерод.)
Шуточные загадки.
1. Какой элемент вращается вокруг Солнца?
(Уран.)
2. Какой металл по древнегреческой мифологии «обречен» на вечные
муки?
(Тантал.)
3. В состав, какого металла входит дерево?
(Никель.)
4. какой благородный металл состоит из болотных водорослей?
(Платина.)
5. Частью какого химического элемента любят играть на досуге взрослые и дети?
(Золото.)
6. Как из меди и мышьяка получить золото?
(Сu + As = Аu +Cs.) Ребусы.
Шесть элементов.
В этих буквенных ребусах зашифрованы шесть химических элементов. Разгадать вам помогут следующие их свойства:
1. Элемент, для которого известны 10 стабильных природных изотопов с массовыми числами от 112 до 124.
(Олово.)
2. Радиоактивный химический элемент, быстрораспадающийся изотоп
которого имеет период полураспада 54 с.
(Астат.)
3. Элемент, высший оксид которого применяют как катализатор в производстве серной кислоты. (Ванадий.)
-
Химический элемент V группы периодической системы.
(Висмут.) -
Щелочной металл. (Натрий.)
6. Металл, составляющий основу многих сплавов для авиационной и ракетной техники, судостроения. (Титан.)
Ребусы, составленные из знаков химических элементов.
В Ne‘ — остров в Малайском архипелаге.
(Борнео.)
«Аu — настольная игра.
(Лото.)
‘Хе’- корм для домашних животных.
(Сено.)
Sn 1=c — структурная единица языка.
(Слово.)
Криптограмма — это игра, в которой необходимо разгадать ключевые слова, приведенные в условии. Каждому числу соответствует определенная буква. Затем числа нужно заменить на буквы в криптограмме и прочитать текст. Класс соединений.
Здесь зашифровано определение одного из классов неорганических соединений:
2, 5, 7, 6, 3, 10 , 7, 8, 2, 11, 14, 10, 12, 1, 12, 20, 12, 7, 9, 1, 4, 7, 2, 7, 9, 2, 19, 20, 6, 12, 6, 13, 3, 1, 21, 17, 15, 8, 12, 18, 12, 14, 9, 2, 1, 2,3,6, 14, 6, 13,5,2,9,2,16, 10, 17, 5, 6, 7, 8, 16, 2, 3.
Ключевые слова:
1, 2, 3, 4 — самое распространенное вещество на Земле;
5, 6, 7, 8, 2, 9, 10 — класс неорганических соединений;
11, 12, 8, 12, 13, 2 — металл, способный намагничиваться;
4, 14, 6, 2, 14 — отрицательно заряженная частица;
15, 8, 12, 5, 9, 16, 2, 3 — общие названия анода и катода;
17, 16, 2, 18 — металл, входящий в состав нержавеющих сталей;
19,3- отравляющее вещество;
20, 12, 8, 2, 5 — раствор золы, ранее используемый для мытья волос;
1, 6, 7, 18, 21, 9 — редкий металл.
Ответ. Ключевые слова: вода, кислоты, железо, анион, электрод, хром, яд, щелок, висмут.
55