
Текст слайда: Тема: «Электрический ток в электролитах». Работу выполнила: Ученица 11 «А» класса МОУ «СОШ № 95 им. Н. Щукина п. Архара» Никитенко Анастасия.

Текст слайда: Цель: Изучить электрические и химические процессы в электролитах.

Текст слайда: Задачи: Доказать что концентрация раствора электролита влияет на силу тока. Установить, как влияет расстояния между электродами на силу тока. Выяснить, как влияет природа электролита на силу тока в нём.

Текст слайда: План I.Введение. II.Основная часть. К истории законов электролиза. Библиографическая справка о М. Фарадеи. Электрический ток в электролитах. III.Практическая часть. IV. Выводы.

Текст слайда:

Текст слайда: ФАРАДЕЙ (Faraday) Майкл (1791-1867) Английский физик, основоположник учения об электромагнитном поле, иностранный почетный член Петербургской АН (1830). Обнаружил химическое действие электрического тока, взаимосвязь между электричеством и магнетизмом, магнетизмом и светом. Открыл (1831) электромагнитную индукцию — явление, которое легло в основу электротехники. Установил (1833-34) законы электролиза, названные его именем, открыл пара- и диамагнетизм, вращение плоскости поляризации света в магнитном поле (эффект Фарадея). Доказал тождественность различных видов электричества. Ввел понятия электрического и магнитного поля, высказал идею существования электромагнитных волн.

Текст слайда: Термин «электролит» (от греческого «разлагаемый электричеством») впервые предложил английский химик и физик М.Фарадей

Текст слайда: Электролитами принято называть проводящие среды, в которых протекание электрического тока сопровождается переносом вещества.

Текст слайда: Прохождение электрического тока через электролит сопровождается выделением веществ на электродах. Это явление получило название электролиза.
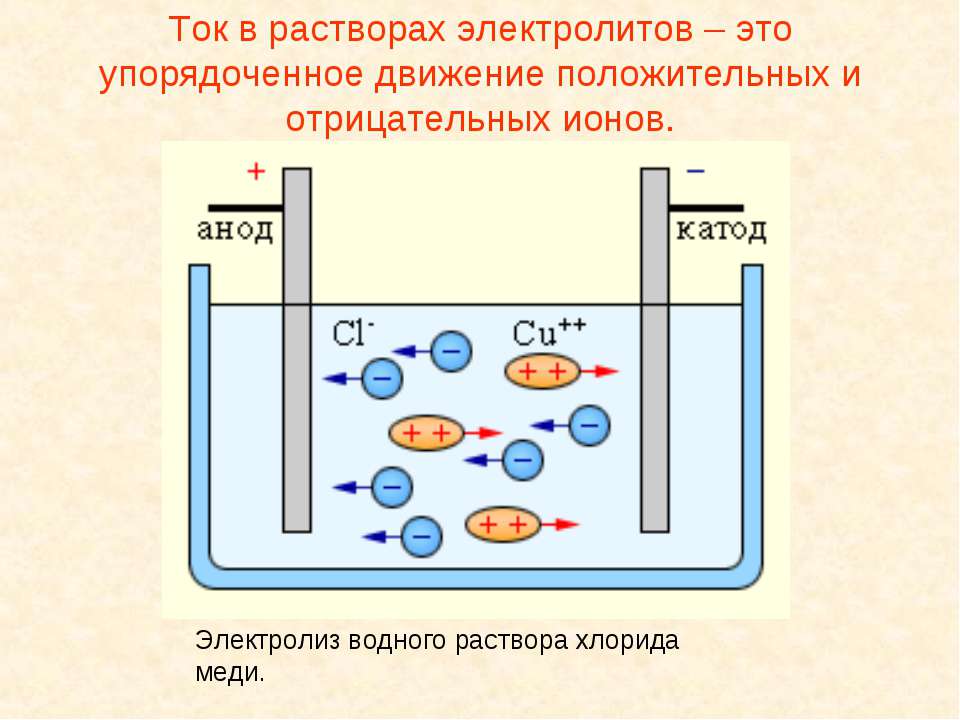
Текст слайда: Ток в растворах электролитов – это упорядоченное движение положительных и отрицательных ионов. Электролиз водного раствора хлорида меди.

Текст слайда: Первый закон электролиза. Закон электролиза был экспериментально установлен английским физиком М. Фарадеем в 1833 году. Закон Фарадея определяет количества первичных продуктов, выделяющихся на электродах при электролизе.

Текст слайда: Первый закон электролиза. Масса m вещества, выделившегося на электроде, прямо пропорциональна заряду q, прошедшему через электролит: m=kq=kIt.

Текст слайда: Второй закон Фарадея Данный закон отвечает на вопрос от чего зависит электрохимический эквивалент. Электрохимические эквиваленты различных веществ пропорциональны их атомным весам и обратно пропорциональны числам, выражающим их химическую валентность.

Текст слайда: Внешний вид установки.
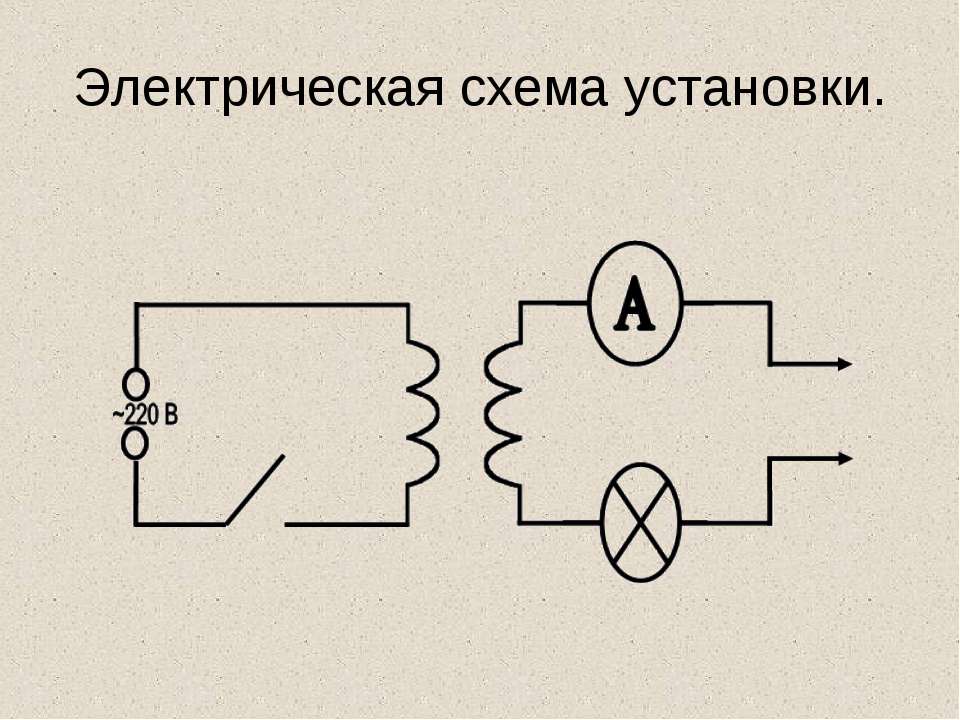
Текст слайда: Электрическая схема установки.

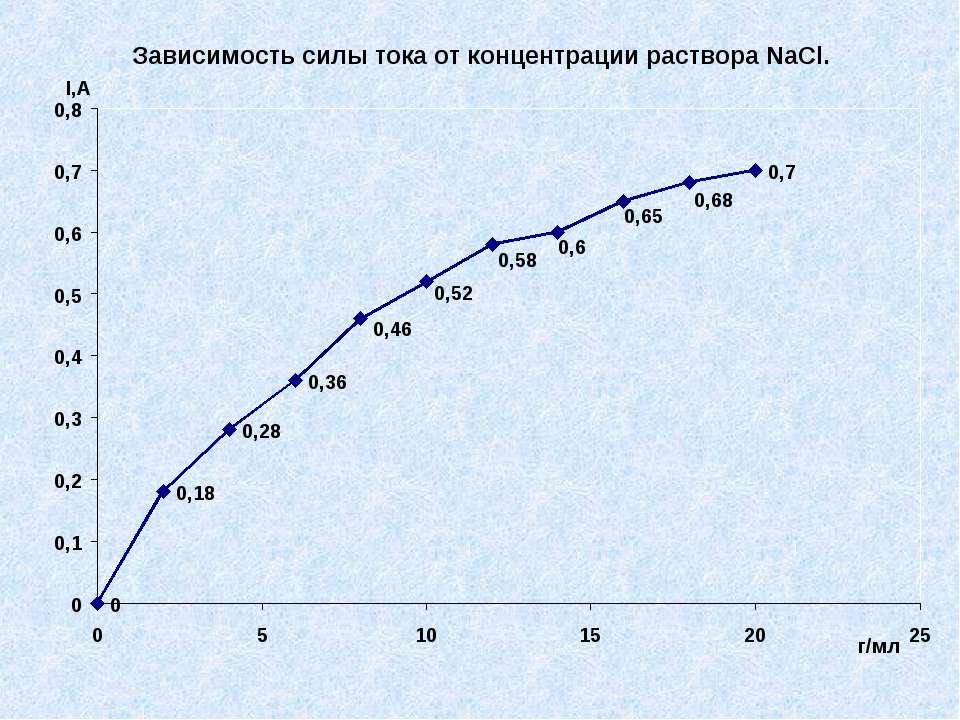
Текст слайда: Практическая часть №1 Доказать что концентрация раствора электролита влияет на силу тока.
Текст слайда:

Текст слайда: Вывод № 1. Сила тока зависит от концентрации раствора, чем насыщение раствор, тем больше сила тока.

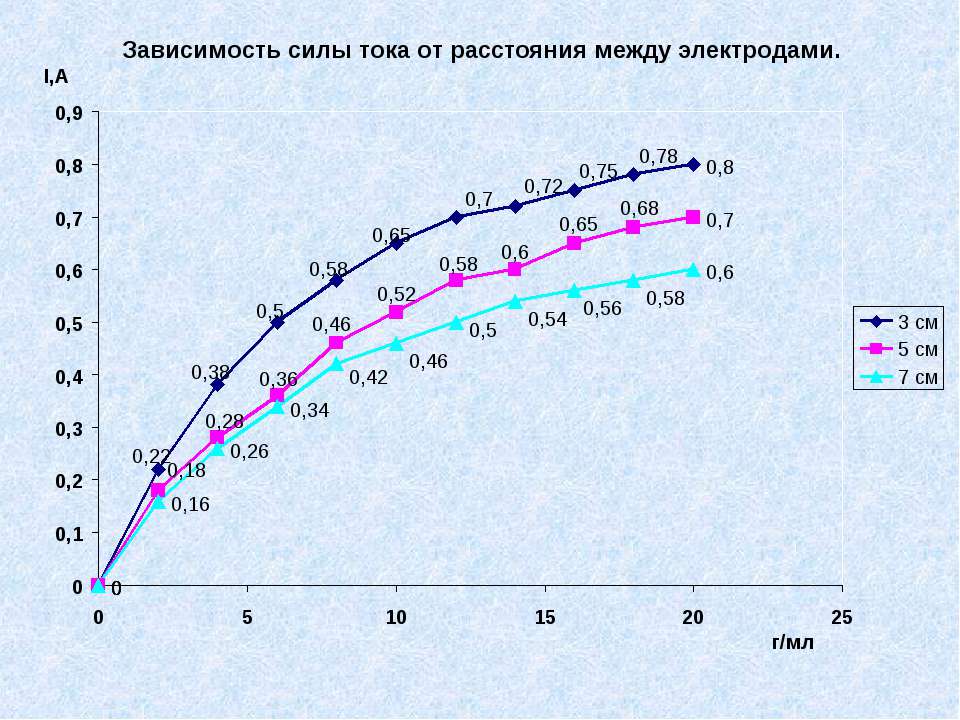
Текст слайда: Практическая часть № 2. Установить, как влияет расстояния между электродами на силу тока.
Текст слайда:

Текст слайда: Вывод № 2. Сила тока зависит от расстояния между электродами, чем меньше расстояние тем больше сила тока и наоборот.

Текст слайда: Практическая часть № 3. Выяснить, как влияет природа электролита на силу тока в нём.
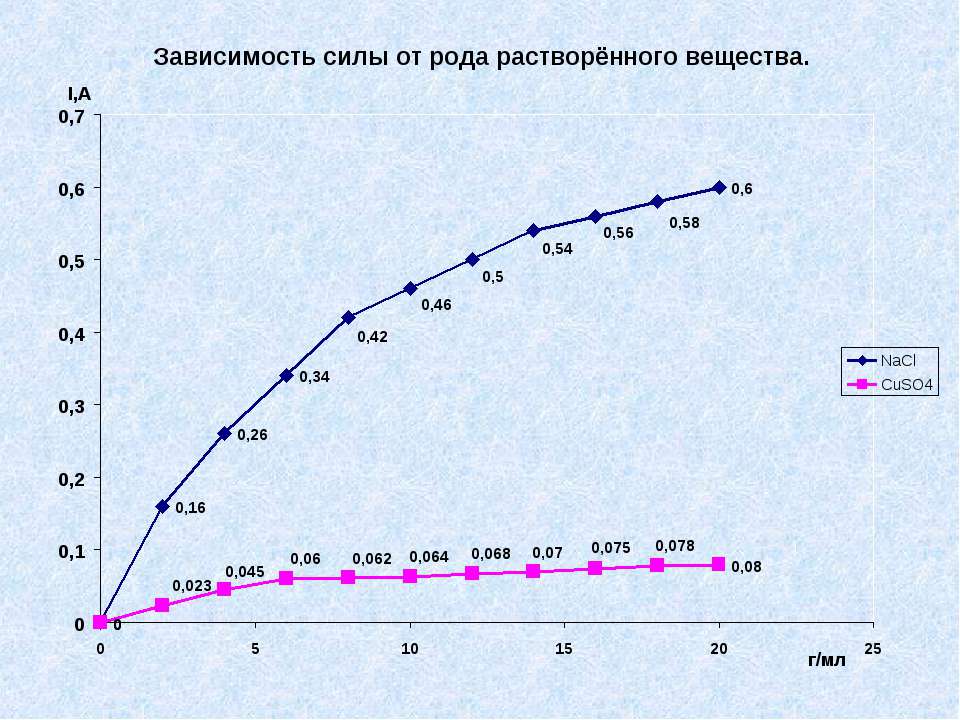
Текст слайда:

Текст слайда: Вывод № 3. Различные электролиты по-разному проводят электрический ток.

Текст слайда: Применение электролиза Электрический метод получения чистых металлов. Гальваностегия. Гальванопластика. Электрическая полировка. Электрометаллургия.

Текст слайда: Вывод: Сам факт разложение электролитов при прохождении через них тока показывает, что в них движения зарядов сопровождается движение атомов или групп атомов, связанных друг с другом; эти атомы или атомные группы представляют собой части молекулы растворенного вещества. Естественно предположить, что заряжены именно эти части молекул в растворе и что они являются носителями электрического заряда. Их перемещение под действием сил электрического поля и представляют собой электрический ток, идущий через электролит. Тщательно поставленные опыты позволили установить, что для электролитов справедлив закон Ома.

Текст слайда: Список литературы. Глинка Н.Л.Общая химия: - Л.: Химия 1985.-704с. Под ред. В.А. Рабиновича. Детлаф А. А., Яворский Б. М.Курс физики: Учеб. Пособие для втузов.- М.:Высш. Шк.1989 Фролов В.В.Химия: - М.: Высш. Шк., 1986.- 543с. «Элементарный учебник физики под редакцией академика Г.С. Ландсберга - Том II – электричество и магнетизм». Москва, «Наука» 1972 год.